Virus de la Hepatitis C
HCV (virus de la hepatitis C) causa una predisposición a la formación de cáncer que permanece en forma de mutaciones en las células B incluso cuando el virus ya no está presente y se ha superado la infección.
Diversos estudios observaron que en algunos casos, después de una infección por HCV se observaba un aumento en la tasa de mutación de entre 5 a 10 veces más a la normal de algunos genes de células las B infectadas por HCV, células mononucleadas de sangre periférica asociadas a HCV, linfomas y en carcinoma hepatocelular in vitro (HCC) [8]. Los genes mayormente afectados eran los siguientes:
- Cadena pesada de inmunoglobulina (Ig)
- Proteína 6 del linfoma de células B (BCL-6)
- Proteína p53
- Genes de la catenina
La conclusión es que se hipotetiza que HCV induce un fenotipo mutagénico causado por mutaciones en oncogenes y protooncogenes que deriva en una transformación tumoral de las células B, incluso cuando ya se ha superado la infección por HCV.
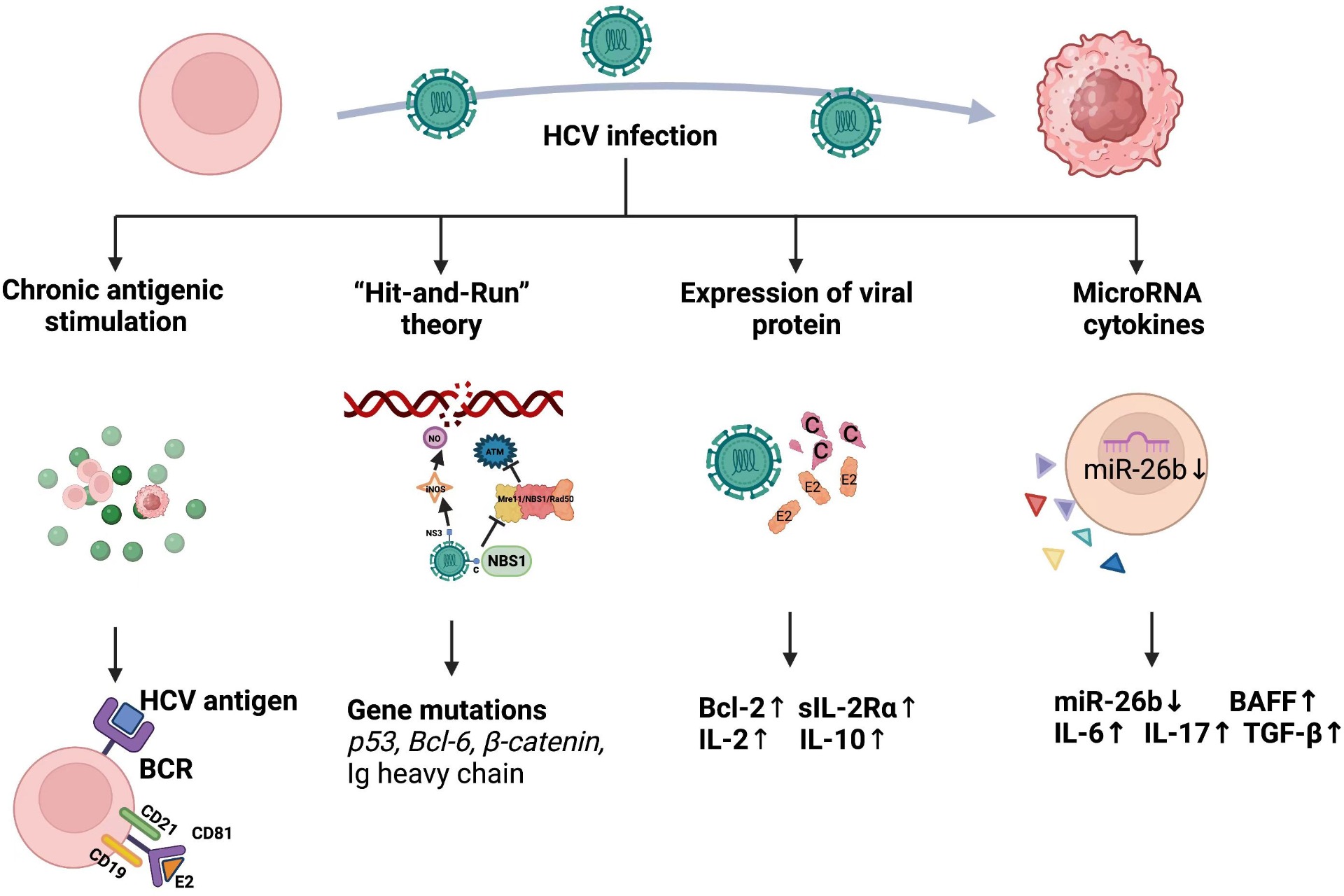
Existen diferentes mecanismos por los que HCV puede hacer que una célula B pase a ser tumoral [8]:
- Estimulación antigénica crónica
- Teoría "Hit-and-Run"
- Expresión de proteína viral
- Desregulación de miRNA y citoquinas
Estimulación antigénica crónica
La proteína de cápside E2 puede hacer disminuir el umbral requerido para la proliferación mediada por BCR de los linfocitos, aumentando así dicha proliferación. El mecanismo por el cual se produce este efecto es mediante la unión de E2 a CD81 expresado en las células B, y la posterior unión de este CD81 al complejo formado por CD19 y CD21 en las células B humanas. Cuando este complejo se une al receptor de antígenos de la célula B (BCR), hace disminuir su umbral y provoca el efecto de aumento de la proliferación.
Además, la unión E2-CD81 también activa al factor de transcripción NF-κB, involucrado en aumentar la expresión de la proteína Bcl-2, que provoca un aumento de la supervivencia de los linfocitos y los protege de la apoptosis mediada por Fas.
Otros efectos que produce la unión de E2-CD81 son prevenir la activación funcional de las células inmunitarias NK, de forma que las células tumorales escapan del sistema inmune, o activar la vía C-JUN N-terminal que da lugar a más proliferación en células B neonatales.
En conclusión, la interacción de la proteína de cápside de HCV con la proteína de membrana CD81 de los linfocitos B promueve la infección crónica por HCV y facilita el desarrollo de linfoma en las células B asociado a HCV. [8]
Desregulación de miRNA y citoquinas
Se ha detectado que HCV desregula la acción de ciertos miRNA de la célula, y esto está implicado en en desarrollo de linfomas asociados a HCV.
En estudios de linfoma de la zona marginal esplénica (SMZL) positivo para HCV se ha detectado una disminución significativa del microRNA-26b, que puede causar que este miRNA deje de inhibir a la quinasa 6 (NEK6) relacionada al gen "never in mitosis gen A" (NIMA), teniendo potencial oncogénico. [8]
Otro miRNA afectado por HCV es miR-181c, cuya diana es ATM, quinasa implicada en la recombinación homóloga para la reparación de daño en el DNA. La infección por HCV inhibe a miR-181c en los hepatocitos, haciendo que se active ATM y inhibiendo la apoptosis promoviendo la progresión del ciclo celular. [9]
Las citoquinas median la interacción entre células inmunes y no inmunes en los tumores y pueden aumentar o reducir el crecimiento celular. La citoquina BAFF (B-cell activating factor) es un importante regulador de este crecimiento y supervivencia celular de células B, y su expresión está aumentada en infecciones por HCV. Se sugiere que BAFF promueve la malignidad de células B ya que en exceso de este y deficiencia de factor de necrosis de tumor (TNF) conlleva un aumento en la incidencia de linfoma en ratones transgénicos para BAFF. [8]
Expresión de proteína viral
Diferentes tipos de evidencia concluyen en que proteínas víricas intracelulares de HCV contribuyen a la transformación oncogénica de los linfocitos B.
Proteínas de la cápside como E2 de HCV se correlacionan con la expresión de interleucinas 2, 10 y 12, así como con la inducción de Bcl 2 en vías de inducción complejas, y se ha correlacionado una expresión aumentada de estos componentes con linfoma de células B. [8]
Teoría "Hit-and-Run"
Esta teoría expresa en la idea de que no es necesaria la replicación intracelular del virus para la transformación tumoral de la célula B, sino que la predisposición al cáncer se puede mantener incluso cuando el virus ya no está presente si la célula ha acumulado mutaciones.
Se centra en la idea de que HCV causa daño en el DNA y mutaciones de distintas formas que acaban dirigiendo a las células B a transformarse en células tumorales incluso cuando el virus ya no está presente. [8]
Posteriormente se comentaran las diferentes formas en las que HCV causa daño en el DNA que puede acabar en mutaciones que provoquen neoplasia.